Akromegali, vücutta hormonal dengesizliğin olduğu bir endokrin bozukluktur. Duruma çok fazla büyüme hormonu (GH) neden olur. Büyüme hormonu normalde hipofiz bezi tarafından üretilir.
Haber Merkezi / Bu, beynin içinde yer alan küçük, bezelye büyüklüğünde bir bezdir. Akromegalide hipofiz aşırı miktarda GH üretir. Fazla üretim, hipofizdeki iyi huylu veya kanserli olmayan bir tümöre bağlı olabilir. Bu tümörlere adenom denir.
Akromegali ve diğer bozukluklar
Akromegali, aşağıdakiler de dahil olmak üzere diğer bozukluklara yol açabilir:
- 2 tip diyabet
- Yüksek tansiyon
- Kalp-damar hastalığı
- İlerledikçe kolon kanserine dönüşebilen kolon polipleri
- Artrit
Gigantizm ve akromegali
Bozukluk çocuklukta ortaya çıkarsa akromegaliden çok gigantizme yol açar. Çocuklarda büyüme hormonu fazlalığı uzun kemiklerin (bacaklarda) aşırı uzamasına ve bu da aşırı boy uzamasına neden olur.
Büyüme hormonuna tepki olarak uzun kemikler, özellikle büyüme plakalarında, yani kemiğin her iki ucuna yakın bölgelerde büyür. Çocuk ergenliğe ulaştığında, büyüme plakaları birleşir ve bu nedenle ergenlik çağına ulaştıktan sonra aşırı büyüme hormonu devleşmeye veya aşırı boy uzamasına yol açmaz.
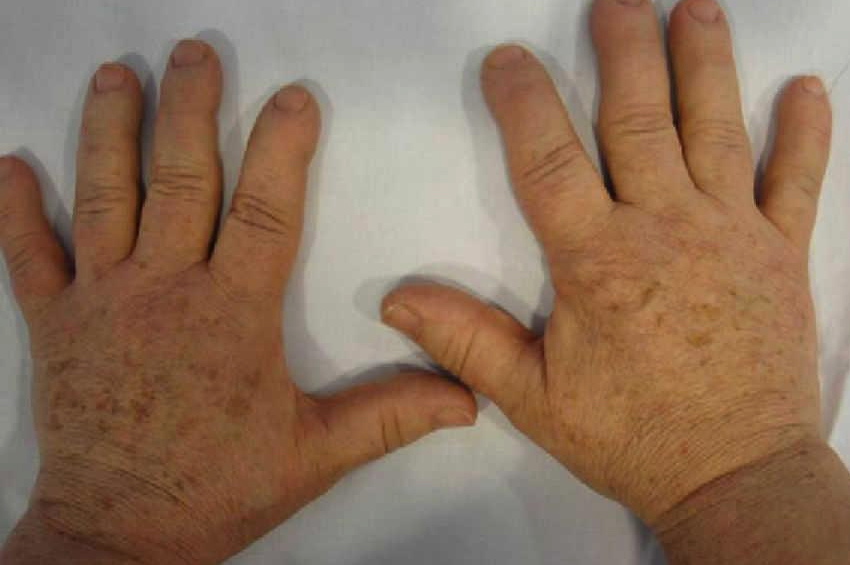
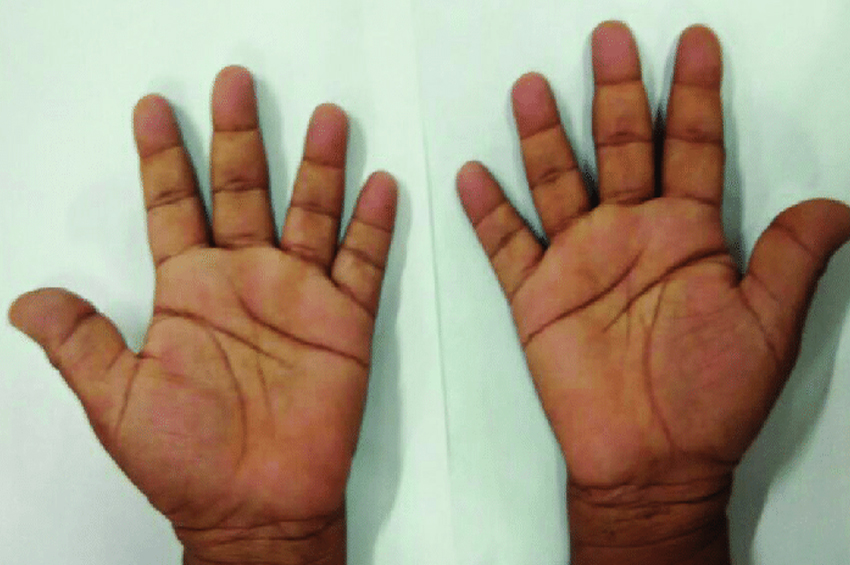
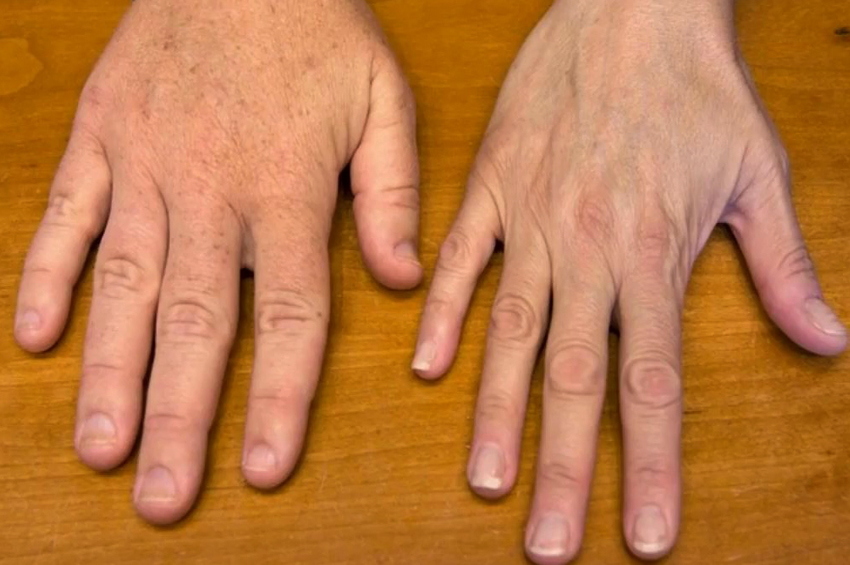
Akromegali hastalarında genellikle uzuvlarında büyüme olmaz. Ancak el, ayak ve yüz kemikleri büyümeye devam edebilir ve bunlar büyümeye başlar. Eller maça gibi görünüyor. Yüz kemikleri yüzün şeklini değiştirmek için büyür. Çene büyür, dişler arasında boşluklar oluşur ve kaşlar daha belirgin hale gelir. Cilt pürüzlü ve yağlı hale gelir ve dilin aşırı büyümesi de olur.
Nedenleri
Büyüme hormonu hipofiz bezi tarafından üretilir ve salınır. Bu, beynin hemen altındaki bezelye büyüklüğünde bir bezdir. Ergenliğe ulaşmadan önce büyüme hormonunun normal salınımı, insanların normal büyümesine izin verir.
Büyüme hormonu salınımını ne uyarır?
Büyüme hormonu salınımı beynin hipotalamus tarafından uyarılır. Hipotalamus, hipofizi düzenleyen hormonları üretir. Büyüme hormonunu düzenleyen hormonlardan biri, hipofiz bezini GH üretmesi için uyaran büyüme hormonu salgılatıcı hormondur (GHRH).
Büyüme hormonu salgılandığında ne olur?
Büyüme hormonu kana salındığında, karaciğeri başka bir hormon – insülin benzeri büyüme faktörü 1 (IGF-1) üretmesi için uyarır. Bu IGF-1, vücutta kas, kemik ve kıkırdak büyümesine neden olur. Yetişkinlerde bu süreç, vücut dokularının büyümesi ve onarımı için gereklidir.
Hormonların düzenlenmesi
Hipotalamus, somatostatin adı verilen başka bir hormon yapar. Bu, GH üretimini ve salınımını engeller. Normalde dört hormonun her birinin seviyeleri – GHRH, Somatostatin, Büyüme Hormonu ve IGF-1, birbirleri ve uyku, egzersiz, kan şekeri seviyeleri, stres vb. diğer faktörler tarafından sıkı bir şekilde düzenlenir.
Akromegali patolojisi
Akromegali , hipofiz bezi tarafından uzun süreli aşırı büyüme hormonu üretiminden kaynaklanır. Bu, aşırı kemik büyümesine ve organ genişlemesine yol açan IGF-1’in aşırı yükselmesine yol açar. IGF-1 seviyelerindeki artış, glikoz ve yağ metabolizmasını değiştirerek kalp hastalığı ve diyabet riskinde artışa neden olur. Akromegali nedenleri hipofiz tümörleri veya hipofiz dışı tümörlere bağlı olabilir.
Hipofiz tümörleri
Bu, durumu olan kişilerin yüzde 95’inden fazlasında akromegalinin nedenidir. Akromegali, adenom adı verilen hipofiz bezinin iyi huylu veya kanserli olmayan bir tümöründen kaynaklanır. Bu tümör aşırı GH üretir.
Hipofiz tümörleri boyutlarına göre belirlenen mikro veya makro adenomlar olabilir. Akromegali genellikle makro-adenomlardan kaynaklanır. Bu, boyutlarının 1 cm’den büyük olduğu anlamına gelir.
Bu daha büyük tümörler ayrıca beynin yakın yapılarına da baskı yapabilir. Tümör yukarı doğru büyürse optik kiazmaya baskı yapar. Bu bölgede, her iki gözden de gözlerden beyne görme ile ilgili bilgi taşıyan optik sinirler kesişir. Tümör optik kiazmaya baskı yaparsa görme sorunları ve görme kaybı olabilir.
Benzer şekilde, tümör yanlara doğru büyürse, beynin kavernöz sinüs adı verilen bir alanı ihlal edilebilir. Bu site, hasar görebilecek birkaç sinir içerir.
Tümörün büyümesi ayrıca hipofiz bezi tarafından üretilen diğer hormonların düzensizliğine neden olur. Bu, kadınlarda cinsel işlev bozukluğu, libido kaybı, anormal adet kanaması ve meme akıntısı gibi sorunlara yol açabilir. Tiroid hormonu üretimi de değiştirilebilir ve yetersiz tiroidlere veya hipotiroidizme yol açabilir.
Hipofiz bezinin işleyişi değişirse , hormon kortizol salgılayan adrenal bez işlevleri de etkilenebilir. Kortizol seviyelerindeki düşüş kilo kaybına, yorgunluğa, düşük tansiyona vb. neden olabilir. Hipofiz adenomlarından prolaktin gibi diğer hipofiz hormonlarının aşırı salgılanması görülebilir. Prolaktin, memeyi süt üretmesi için uyarır.
Çoğu hipofiz tümörü kendi kendine gelişir ve genellikle genlere bağlı değildir ve kalıtsal değildir. Hipofiz hücresinin DNA’sı, tümöre yol açacak şekilde değiştirilebilir. Buna mutasyon denir ve doğumdan beri mevcut değildir. Mutasyon, kimyasal sinyallerin iletimini düzenleyen ve hücrelerden kontrolsüz bölünmeye devam etmelerini isteyen sinyali kalıcı olarak açan bir gende meydana gelir.
Hipofiz dışı tümörler
Akromegali çok nadir vakalarda hipofiz dışı tümörlerden de kaynaklanabilir. Diğer tümörler arasında akciğerler, pankreas ve beynin diğer bölümleri bulunur. Bu tümörler ayrıca ya kendileri GH ürettikleri için ya da hipofizi GH salması için uyaran GHRH ürettikleri için aşırı GH’ye yol açarlar. Bu sekonder tümörlerden aşırı GHRH üretimi varsa, hipofizin boyutu artabilir ve yanlış bir hipofiz tümörü şüphesine yol açabilir.
Belirtileri;
Akromegalinin yavaş veya kademeli bir başlangıcı vardır ve semptomların ortaya çıkması da yavaştır. Mevcut fotoğraflar veya görünüm önceki fotoğraflarla karşılaştırılmadıkça, görünüşteki bariz değişiklikler hemen tespit edilemeyebilir.
Akromegali belirtilerinden bazıları şunlardır:
- El ve ayakların büyütülmesi. Eller maça gibi görünür ve ayaklar, halihazırda kullanılan ayakkabıların rahatsız olmasıyla birlikte büyümeye devam eder.
- Eklem ağrıları
- Ellerin aşırı büyümesi nedeniyle, Median sinir adı verilen bilek sinirleri sıkışabilir ve bu da Karpal tünel sendromu adı verilen ağrılı bir duruma neden olabilir. Karpal tünel sendromu görülmese bile küçük sinirlerin sıkışması nedeniyle ellerde ve ayaklarda karıncalanma hissi olabilir.
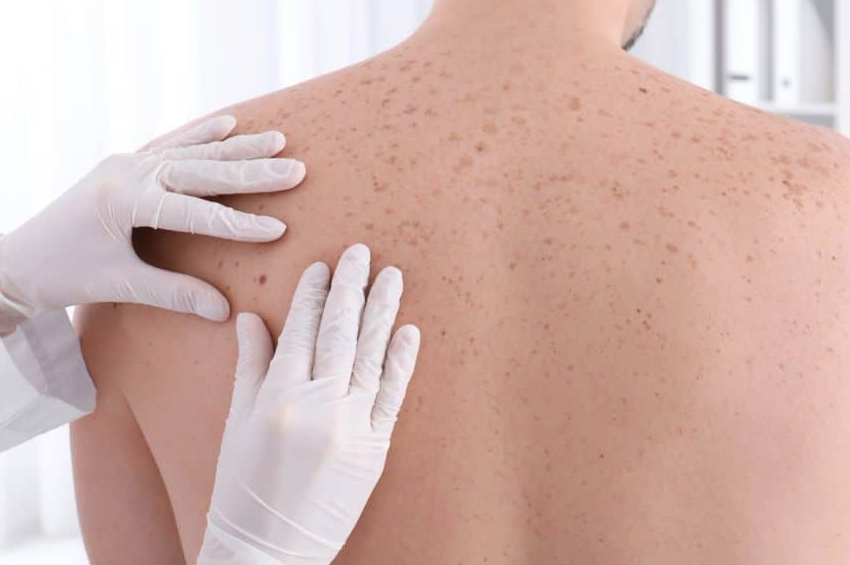
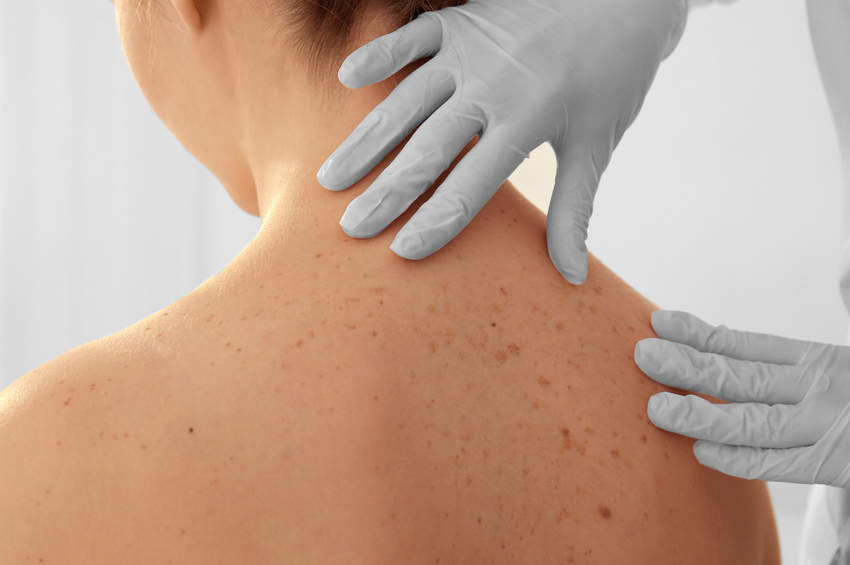
- Kalın, pürüzlü ve yağlı cilt. Ayrıca aşırı terleme, vücut kokusu ve cilt beneklerinin varlığı da söz konusudur. Cilt etiketleri, özellikle yüz ve boyunda ciltten sarkan küçük cilt dokusu parçalarıdır.
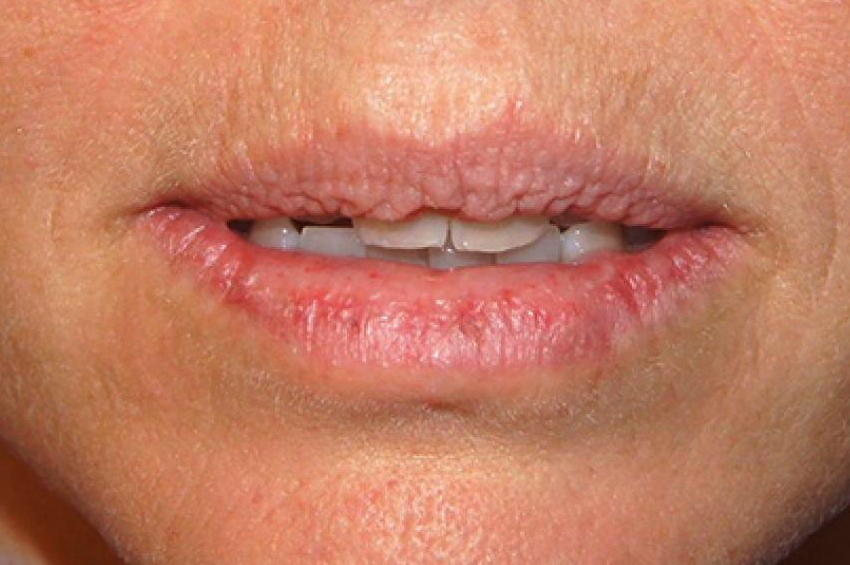
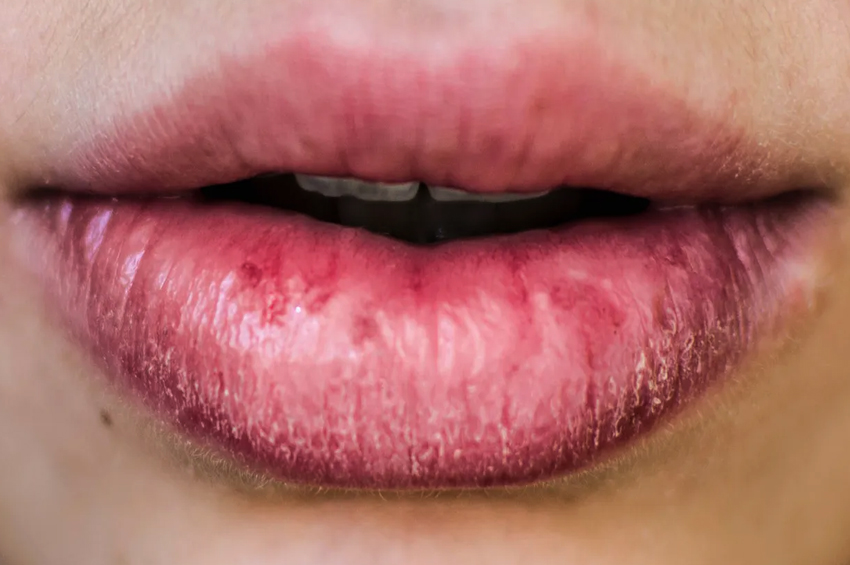
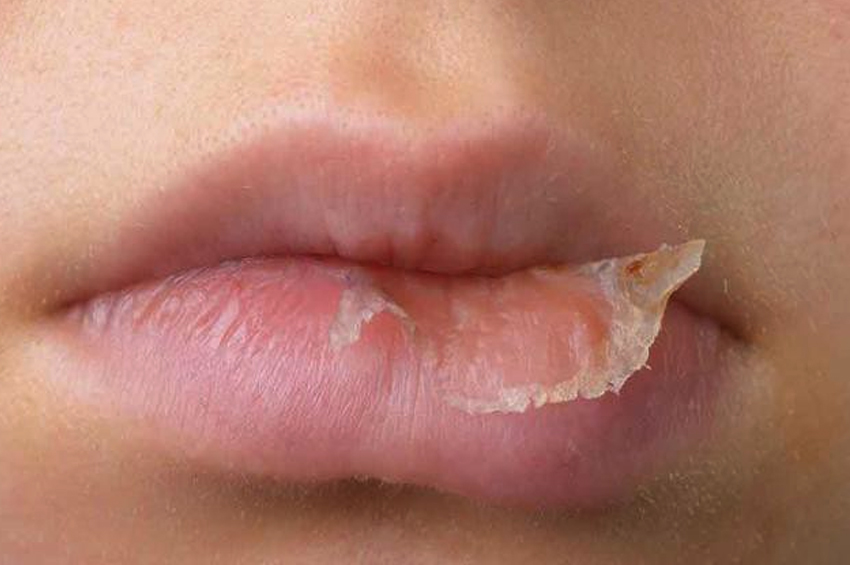
- Dudakların ve burnun büyütülmesi. Çıkıntılı bir kaş ve büyümüş dil ve çene olabilir. Dişler de geniş aralıklı hale gelir. Bu, görünümü önemli ölçüde değiştirir. Alt çenede bir çıkıntı vardır ve buna prognatizm denir.
- Sesin kalınlaşması ve kabalaşması var. Bunun nedeni sinüslerin ve ses tellerinin genişlemesidir. Dilin büyümesi, boyun ve boğazın arkasındaki yapılar nedeniyle uyku sırasında da uyku apnesi veya hava yollarında tıkanıklık olabilir. Bu da gün içinde uykusuzluktan dolayı halsizliğe, yorgunluğa ve yorgunluğa yol açar.
- Yüz kemiklerinin değişmiş büyümesi nedeniyle baş ağrısı ve görme bozukluğu olabilir. Baş ağrısı, hipofiz bezi tümörünün büyümesinin yakındaki dokulara ve sinirlere baskı yaptığını da gösterebilir.
- Erkeklerde cinsel istek veya libido kaybı ve iktidarsızlık ile cinsel işlev bozukluğu ve kadınlarda anormal dönemler vardır.
- Artrit yaygın olarak görülebilir.
- Kalp, karaciğer, prostat, böbrekler ve tiroid bezleri gibi vücut organlarının boyutları artabilir.
- Yüksek tansiyon, kalp yetmezliği, kalp ritmi anormallikleri ve kardiyomiyopatileri içeren kalp hastalıkları yaygın olarak görülmektedir.
- Hipofizden bir hormon olan Prolaktin’in artan salgılanması, kadınlarda galaktore (meme akıntısı) ve amenoreye (adet görmeme) yol açabilir.
Komplikasyonları
Akromegali tedavi edilmediği takdirde çeşitli komplikasyonlara neden olabilir. Bu komplikasyonlar, hastalığın semptomları gibi, kademeli olarak başlar ve gelişmesi aylar veya yıllar alabilir.
Bu komplikasyonlara karşı dikkatli olmak akromegali yönetiminin bir parçasıdır. Komplikasyonlardan bazıları şunlardır: –
- Kalp hastalığı – akromegali, kalp krizi ve anjina riskinin kötüleşmesine yol açan iskemik kalp hastalığı riskini artırır. Kalbin büyümesi ve vücudun talepleri ile kalbin kan pompalama kapasitesi arasındaki dengesizlik ile kalp yetmezliği riski de artar.
- Akromegali hastalarında inme riski de artmaktadır.
- Akromegali hastalarında diabetes mellitus riski büyük oranda artmaktadır.
- Akromegali olan hamile kadınların gestasyonel diyabet ve hamileliğe bağlı hipertansiyon veya yüksek tansiyon geliştirme riski yüksektir. Bu, erken doğum veya ölü doğum riskini artırabilir.
- Akromegali hastaları artrit ve eklem ağrıları açısından da risk altındadır. Buna Akromegalik artropati denir ve hastaların %70’ini etkiler. Hem eksenel hem de periferik iskelet etkilenebilir. Bu, omurganın yanı sıra uzuvların eklemlerini de içerir. El sinirlerinin sıkışması nedeniyle hastada Karpal tünel sendromu gelişebilir.
- Boğazın arkası ve dildeki yapıların aşırı büyümesi nedeniyle Obstrüktif uyku apnesi gelişebilir ve bu da uykunun bölünmesine yol açar.
- Kolonik polip gelişme riski yüksektir. Bu polipler, erken tespit edilip çıkarılmazsa kolon veya bağırsak kanserinin adenokarsinomunu oluşturabilir. Akromegali hastaları bu nedenle bağırsak kanseri için erken ve düzenli tarama gerektirir.
- Hipofiz tümörü, hipofiz bezi tarafından prolaktin hormonunun salgılanmasında artışa neden olabilir. Hipofiz hormonu üretimindeki kusurlar nedeniyle kortizol, tiroid hormonu üretimi ve seks steroidlerinde ek eksiklikler olabilir.
- Hipofiz tümörü büyüdükçe optik kiazmaya baskı yapabilir. Bu optik kiazma, her iki gözden gelen optik sinirlerin birleştiği bir bağlantı noktasıdır. Kiazmaya basıldığında, ciddi görme bozukluğu olabilir. Görme kaybı tipik olarak dış görme alanlarını etkiler ve bitemporal hemianopi olarak adlandırılır.
- Akromegalinin bir komplikasyonu olarak şiddetli baş ağrısı görülebilir.
- Cerrahi veya radyasyon tedavisinin bir komplikasyonu olarak akromegali hastalarında hipopitüitarizm gelişebilir. Bu, hipofiz tarafından salgılanan hormonlarda ciddi düşüşe yol açar. Bunlar genellikle ömür boyu değiştirme gerektirebilir.
- Böbrek yetmezliği geliştirme riski vardır.
Teşhisi
Akromegali yavaş bir seyir gösterir ve semptomların gelişmesi genellikle aylar hatta yıllar alır. Durumdan şüpheleniliyorsa, teşhis testleri reçete edilir. Testler aşağıdaki gibi özetlenmiştir.
Kan Testleri
Vücuttaki büyüme hormonu seviyelerini tespit etmek için kan testleri yapılır. Akromegali hastalarında büyüme hormonu seviyeleri yükselir.
Tanı için, kandaki yüksek büyüme hormonu seviyesinin tek bir ölçümü yeterli değildir. Bunun nedeni, normalde bu hormonun hipofiz tarafından impulslar veya spurts olarak salgılanması ve kandaki konsantrasyonu dakikadan dakikaya değiştirebilen birkaç sivri ve dalgaya sahip olmasıdır. Bu nedenle, Akromegali hastalarında bir noktada normal büyüme hormonu seviyeleri olabilir ve normal hipofiz fonksiyonuna sahip bir kişi, aynı zamanda birkaç kat daha yüksek bir seviyeye sahip olabilir.
Böylece anormal büyüme hormonu salgısı seviyeleri hakkında doğru bir fikir edinmek için kişi test koşullarına tabi tutulur. Sağlık uzmanları, Akromegali’yi teşhis etmek için sıklıkla oral glukoz tolerans testini kullanır.
75 ila 100 gram glikoz solüsyonu içen normal bir insanda, büyüme hormonunun kan seviyeleri mililitrede 1 nanogramın (ng/ml) altına düşer. Akromegali ve büyüme hormonu fazlalığı olanlarda bu baskılanma olmaz. Bu nedenle oral glukoz tolerans testi, Akromegali tanısını doğrulamak için güvenilir bir yöntemdir.
İnsülin benzeri büyüme faktörü 1’in (IGF-1) kan seviyelerini ölçmek için testler de reçete edilir. Büyüme hormonu seviyesi yükseldikçe bu seviye yükselir. IGF-I seviyeleri, gün boyunca büyüme hormonundan çok daha stabil olduğundan, IGF-1 seviyeleri ile Akromegali taraması daha güvenilir bir yöntemdir.
Yüksek IGF-I seviyeleri hemen hemen her zaman Akromegali’yi gösterir. Bununla birlikte, hamileliğin IGF-1’de iki ila üç kat fizyolojik bir artışa neden olduğu ve yaşla birlikte IGF-1 seviyelerinin düştüğü unutulmamalıdır. Kötü kontrollü diyabet veya karaciğer veya böbrek hastalığı olan kişilerde seviyeler düşük olabilir.
IGF-bağlayıcı protein-3 (IGFBP-3) vücutta dolaşan IGF’ye bağlanan bir proteindir. IGF-1 seviyeleri yükseldiğinde bu protein seviyeleri de yükselir. Akromegali tanısında kullanılabilir. Büyüme hormonu salgılatıcı hormon (GHRH) konsantrasyonu tahmin edilebilir.
Hipofiz bezinin tutulumu ile diğer hormonlar etkilenebilir. Prolaktin, adrenal, tiroid ve gonadal hormonlar dahil olmak üzere bu hormonların değerlendirilmesi anormallikleri tespit etmeye yardımcı olabilir.
Ayrıca kan şekeri, serum fosfat ve serum trigliseritleri de yükselebilir. İdrar muayenesi yükselmiş idrar kalsiyum seviyelerini ortaya çıkarabilir.
Görüntüleme çalışmaları
Kan seviyelerinin Akromegali’nin göstergesi olduğu tespit edildikten sonra, görüntüleme çalışmaları reçete edilir. Beyin ve hipofiz bezinin manyetik rezonans görüntüleme (MRI) taraması, özellikle araştırma için ilk tercihtir. Bu, tümörün yerini ve boyutunu tespit etmeye yardımcı olur.
MRG en hassas görüntüleme tekniğidir ancak alternatif olarak bilgisayarlı tomografi (BT) taramaları kullanılabilir.
Büyüme hormonu veya Büyüme hormonu salgılatıcı hormon (GHRH) salgılayan başka bir yerde hipofiz dışı tümörü olan hastalarda BT taraması veya tüm vücut MRI taraması reçete edilebilir.
Somatostatin ile tüm vücut sintigrafisi, bazı hastalarda bu hipofiz dışı tümörlerin tespiti için reçete edilir.
Görme alanı testleri
Optik kiazma ve optik sinirlerdeki hasarın derecesini görmek için görme alanı testleri yapılır.
Elektrokardiyogram ve ekokardiyogram
Hastalar Elektrokardiyogram ve ekokardiyogram ile kalp hastalığı taraması yapılır. Akromegali hastalarında kolon kanseri ve kolon polip riski yüksek olduğundan, aynı şekilde değerlendirilmesi gerekir.
Tedavisi;
Akromegali tedavisi, aşırı büyüme hormonunu azaltmayı, tümörün çevre yapılara uyguladığı baskıyı hafifletmeyi ve böylece hastalığın semptomlarını iyileştirmeyi amaçlar. Tedavi edilmezse durum kötüleşebilir ve sonunda ciddi semptomlara ve ölüme yol açabilir.
Tedavi iki şekilde yapılabilir;
Cerrahi tedavi
Akromegali vakalarının çoğunda (% 85), durumun nedeni hipofiz bezindeki bir adenomdur. Bu kanserli olmayan ve iyi huylu bir tümördür ancak beynin çevredeki hayati yapılarına baskı yaparak görme kaybı gibi ciddi semptomlara neden olabilir.
Bu tümörü çıkarmak için ameliyat yapılır. Bazen tümör tamamen çıkarılamayacak kadar büyüktür. Bir hipofiz adenomunun çıkarılması genellikle genel anestezi altında yapılır, burada hasta ameliyat sırasında bilinçsiz hale getirilir. Cerrah, beze erişmek için burun içinden veya üst dudağın içinden bir kesi yapacaktır. Daha sonra tümör çıkarılır ve bu, çevredeki yapılar üzerindeki baskının dramatik bir şekilde azalmasına ve büyüme hormonu seviyelerinin düşmesine neden olabilir.
Trans-sfenoidal cerrahi çoğu durumda tercih edilen tedavi yöntemidir. Mikroadenomlar için %80-85, makroadenomlar için %50-65 remisyon veya kür oranına sahiptir. Ameliyattan sonra hastaların büyüme hormonu düzeylerini düşürmek için ilaç tedavisine ihtiyacı olabilir.
Çoğu durumda, tümör çok büyük değilse cerrahi başarılı tedavidir. Ameliyattan sonra birkaç gün içinde kaybolabilecek bazı yumuşak doku şişlikleri ve morluklar olabilir.
Başarılı olmasına rağmen, hipofiz cerrahisi karmaşıktır ve hipofiz bezinin sağlıklı kısımlarına zarar verme, beyin omurilik sıvısı sızıntısı, kanama ve enfeksiyon gibi çeşitli komplikasyonlara yol açabilir.
Akromegali için radyasyon tedavisi
Hipofiz tümörü büyükse ve ameliyat mümkün değilse, radyasyon tedavisi kullanılarak tümör küçültülebilir. Radyasyon tedavisinin bir dezavantajı vardır: Radyasyondan sonra büyüme hormonu seviyelerindeki azalma çok yavaştır.
Ek olarak, tüm bezin hasar görme riski vardır ve bu da bezden diğer hormonların üretiminde kademeli bir düşüşe neden olabilir. Bu, hastanın hayatının geri kalanı için hormon replasman tedavisini gerektirir. Ayrıca hipofizden gelen üreme hormonları üzerindeki etkileri nedeniyle radyasyon kısırlığa neden olabilir.
Radyasyon, tümörün dış ışınlarla hedeflendiği durumlarda geleneksel form olarak verilebilir. Hastanın dört ila altı hafta boyunca büyük bir X ışını benzeri makineden küçük dozlarda radyasyon alması için radyoloğun ofisine gitmesi gerekir. Normal dokuların iyileşmesine izin vermek için hafta sonları izin verilir. Bu tür radyasyon, hipofiz bezini ve beyin dokularını çevreleyen yapılara zarar verir.
Radyasyon ayrıca stereotaktik dağıtım olarak da verilebilir. Bu yöntemde yüksek doz radyasyon ışını tam olarak tümöre hedeflenebilir. Baş, sert bir kafa çerçevesi takılarak sabit tutulur. Işın genellikle tek seansta tümör hücrelerini öldürür.
İlaç tedavisi veya tedavi amaçlı ilaç kullanımı
Akromegali tedavisinde kullanılan ilaçlar şunlardır:
- Bromokriptin veya kabergolin, büyüme hormonu üretimini baskılar. Ancak bunlar az sayıda hastada etkilidir. Bunlar dopamin agonistleridir.
- Oktreotid veya lanreotid, büyüme hormonu salınımını kontrol eder ve ayrıca akromegali hastalarının üçte birinde hipofiz tümörünün küçülmesine neden olur. Bunlar somatostatin analoglarıdır. Somatostain, vücutta normal olarak büyüme hormonu salınımını engeller. Bunlar ayda bir kez kas içi enjeksiyonlar olarak verilir. Bunlar uzun vadede güvenle kullanılabilir.
- Pegvisomant, büyüme hormonunun etkilerini doğrudan bloke eder ve semptomları iyileştirebilir. İnsan büyüme hormonunun genetiği değiştirilmiş bir analoğudur ve seçici bir büyüme hormonu reseptörü antagonistidir. Hastalarda %90 ila %100 oranında IGF-1’i düşürebilir. Bu, günde bir kez enjeksiyon olarak verilir. Tedavi sırasında büyüme hormonu seviyeleri yükselir ve tümör boyutunda azalma görülmez. Pegvisomant, cerrahi, radyoterapi veya somatostatin analoglarına yetersiz yanıt veren hastalarda akromegali tedavisi için lisanslıdır.
Dikkat: Sayfa içeriği sadece bilgilendirme amaçlıdır.