Lösemi, beyaz kan hücrelerinin kanseridir. Halk dilinde kan kanseri denir. Akut lösemide durum, kronik lösemiden farklı olarak hızla ilerler. Lösemiler, akut ve kronik ilerlemelerine ve ayrıca lenfoid veya miyeloid hücre kökenlerine göre sınıflandırılır. Akut miyeloid lösemi ayrıca alt tiplere ayrılır. Çoğu kanser ve katı tümör, hücre tipine, saldırganlığa ve diğer organlara yayılma eğilimine göre sınıflandırılır.
Haber Merkezi / Ancak AML’nin sınıflandırmaları, hücrelerin görünümüne ve genetik anormalliklerine dayanmaktadır. AML’yi alt tiplere ayırmak için kullanılan iki ana sistem vardır. Bunlardan biri, daha önce kullanımda olan ve yerini daha yeni Dünya Sağlık Örgütü (WHO) sınıflandırması alan Fransız-Amerikan İngiliz (FAB) sınıflandırmasıdır.
AML’de ne olur?
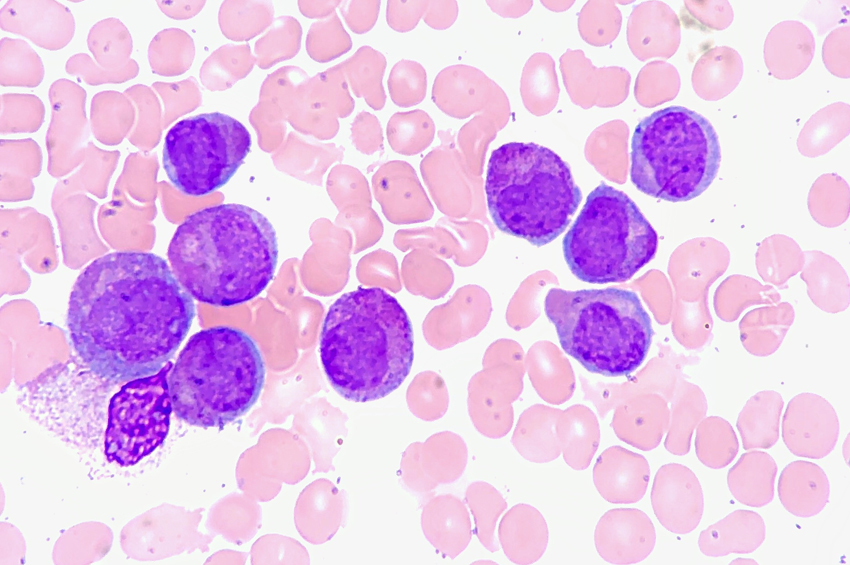
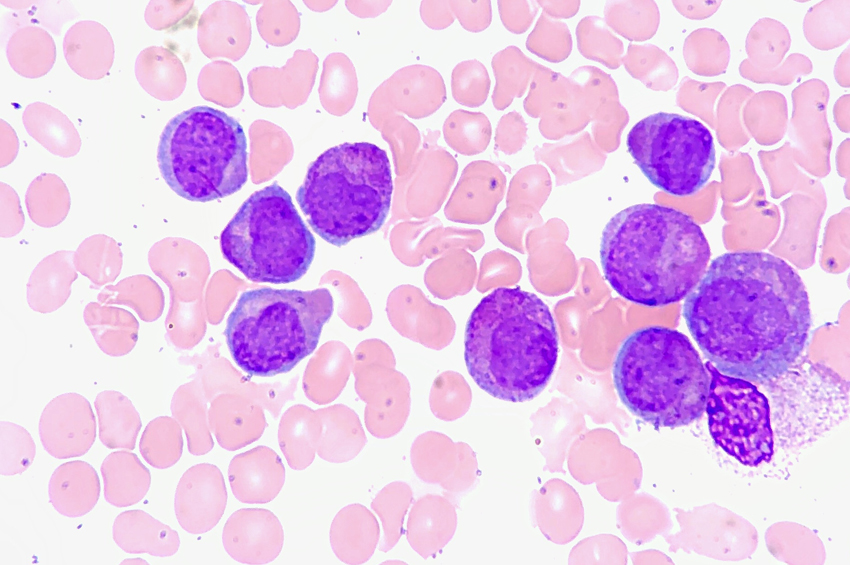
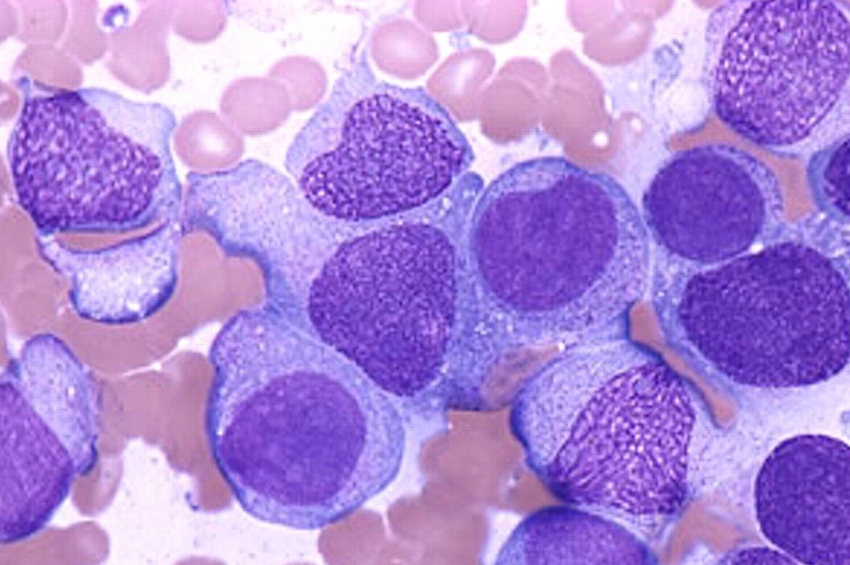
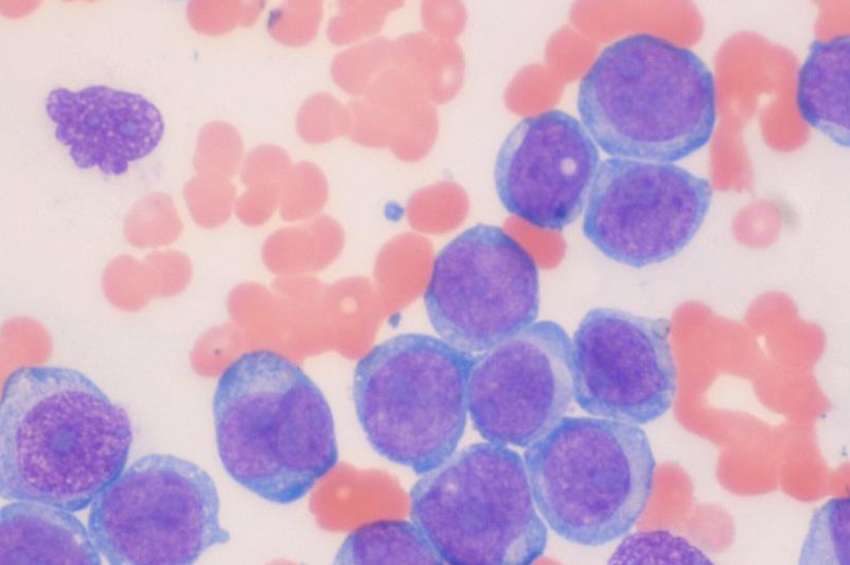
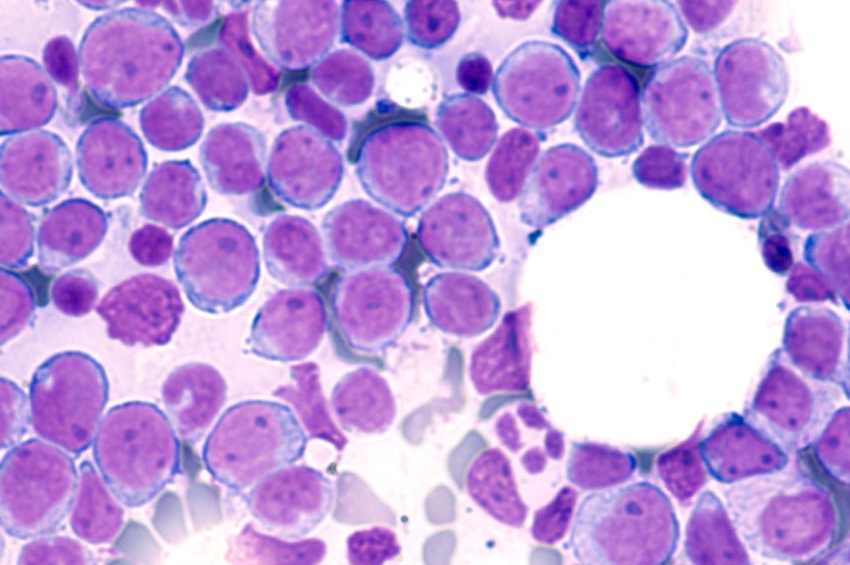
Lösemide, etkilenen kemik iliği yetişkin ve olgun hücreleri serbest bırakamaz ve blast hücreleri olarak bilinen çok sayıda olgunlaşmamış beyaz kan hücrelerini serbest bırakır.
Bu patlama hücreleri, kandaki hücrelerin normal dengesini bozarak kırmızı kan hücrelerinin eksikliğine neden olarak anemiye ve trombositlerin kanama eğilimlerine neden olur.
Yetişkin ve olgun beyaz kan hücrelerinin eksikliği, enfeksiyon riskinin de artması anlamına gelir. AML’de miyeloid öncüleri etkilenir ve kontrolsüz bir şekilde büyür ve çoğalır.
Nedenleri
Akut miyeloid lösemi (AML), kemik iliği kök hücrelerindeki DNA ve genlerin genetik mutasyon olarak bilinen değişikliğe uğramasıyla başlar. Bu, hücrelerin kontrolsüz büyümesine ve çoğalmasına yol açar ve patlama adı verilen bu olgunlaşmamış beyaz kan hücreleri, olgunlaşmadan önce kan dolaşımına salınır.
Normalde DNA’daki mutasyonlar ve değişiklikler kendiliğinden düzelir veya hücre programlanmış bir ölüme uğrar. Kanser oluştuğunda bu haydut hücre bölünmeye devam eder ve kanser yayılır. Kanserli değişime tam olarak neyin sebep olduğu henüz bilinmiyor.
AML için risk faktörleri
AML alma riskini artırabilecek birkaç risk faktörü vardır. Ancak, bu risk faktörlerine maruz kalan tüm kişilerde kanser gelişmeyebilir. Bu tetikleyiciler veya risk faktörleri, çocukluktan beri mevcut olabilir ve yaşamın çok sonraki dönemlerinde kansere dönüşebilir.
Çoğu uzman, çocukluk çağı lösemileri için “iki vuruşlu” bir teori önermektedir. Teori, ilk vuruşun çocuğun genetik bir mutasyonla doğması ve ikinci vuruşun kansere neden olan bir çevresel veya yaşam tarzı tetikleyicisine maruz kalması olabileceğini tahmin ediyor. AML için risk faktörleri şunları içerir:
- Sigara dumanına maruz kalma; AML için bilinen en iyi kanıtlanmış yaşam tarzına bağlı risk faktörü sigara içmektir. Sigara içmek akciğer, ağız, boğaz ve gırtlak kanserleri ve AML gibi lösemilerle ilişkilendirilmiştir.
- Bazı kimyasallara maruz kalma; Çevrede ve kimyasallarda belirli toksinlere maruz kalındığında AML riski artar. Bunlar benzen içerir. Benzen, kauçuk, kimya fabrikaları, ayakkabı imalatı, petrol rafinerileri, benzinle ilgili endüstriler vb. gibi çeşitli endüstrilerde çözücü olarak kullanılır. Ayrıca yapıştırıcılarda, temizlik ürünlerinde, deterjanlarda, boyalarda ve sigara dumanında bulunur. Formaldehite maruz kalma da AML ile ilişkilendirilmiştir ancak kesin ilişki bilinmemektedir.
- Daha önce kemoterapiye maruz kalma; Daha önce kemoterapi görmüş hastalarda AML gelişme olasılığı daha yüksektir. Bu ikincil lösemilerle bağlantılı ilaçlardan bazıları (tedaviyle ilgili lösemiler olarak da bilinir) mekloretamin, prokarbazin, klorambusil, melfalan, etoposid, teniposid ve siklofosfamidi içerir.
- Radyasyona maruz kalma; Yüksek düzeyde radyasyona maruz kalma, AML ve ayrıca akut lenfoblastik lösemi (ALL) için bilinen bir risk faktörüdür. Bu ilk olarak, genellikle maruziyetten sonraki 6 ila 8 yıl içinde akut lösemiye yakalanma riskinin büyük ölçüde arttığı atom bombasından kurtulan Japonlar arasında kaydedildi. Radyasyon, kanserler için radyasyon tedavisinden, X ışınları ve BT taramaları gibi görüntüleme çalışmalarından gelen radyasyondan kaynaklanabilir. Doğmamış bir bebeğin gelişiminin ilk aylarında radyasyona maruz kalması da akut lösemi riskini artırabilir.
- Kan hastalıkları; Bazı kan hastalıklarının kendisi AML alma riskini artırabilir. Bunlar, polisitemi vera, esansiyel trombositopeni ve idiyopatik miyelofibroz gibi kronik miyeloproliferatif bozuklukları içerir. Miyelodisplastik sendromu olanlar (bir lösemi öncesi durum) AML geliştirebilir. Kronik miyeloid lösemili (KML) olanlar daha sonra bir AML formu geliştirebilir. Bu bozuklukların kemoterapi ve radyasyon tedavisi ile tedavisi de AML riskini artırır.
- Konjenital sendromlar; Ailelerde görülen bazı konjenital sendromlar AML ile ilişkilendirilmiştir. Bunlar Down sendromu, Klinefelter sendromu, Fanconi anemisi, Ataksi-telanjiektazi, Bloom sendromu, Blackfan-Diamond sendromu vb.
- Cinsiyet; AML erkeklerde kadınlara göre biraz daha sık görülür ve nedenleri net değildir.
- Etnik köken ve ırk; AML, Kafkasyalılar arasında Afrikalı Amerikalılardan daha sık görülür.
- Diğer potansiyel risk faktörleri; Diğer kanıtlanmamış risk faktörleri arasında elektrik şebekeleri ve cep telefonu kuleleri vb. gibi elektromanyetik alanlara maruz kalma, pestisitlere ve diğer bazı kimyasallara, saç boyalarına ve ağartıcılara ve sigara dumanına maruz kalma yer alır.
Belirtileri
Akut miyeloid löseminin semptomları genellikle başlangıçta yavaştır, ancak olgunlaşmamış beyaz kan hücrelerinin (blast hücreleri) sayısı arttıkça ve kandaki diğer hücrelerle aşırı kalabalıklaştıkça hızla şiddetlenebilir. AML semptomları, kanserin altında yatan patolojinin göstergesidir. AML’nin semptomları şunları içerir:
Genelleştirilmiş semptomlar;
- Kilo kaybı
- Tükenmişlik
- Ateş
- Gece terlemeleri
- İştah kaybı
Açıklanamayan ve uzun süreli ateş semptomlardan biri olabilir. Ateş genellikle 38C’nin (100.4F) üzerindedir. Ateşe genellikle aşırı terleme ve gece terlemeleri eşlik eder.
Cilt ve mukus zarları soluktur. Ağız içindeki mukoza zarları ve konjonktiva genellikle soluk görünür. Bu, aneminin ayırt edici işaretidir.
Kandaki blast hücrelerinin sayısındaki artış nedeniyle kırmızı kan hücrelerinin sayısı azalır ve bu anemiye neden olabilir. Yorgunluk ve halsizlik, anemi ile ilişkili semptomlardır ve AML hastalarında yaygın olarak görülür. Hasta soğuk, baş dönmesi ve sersemlik hissedebilir.
Anemi nedeniyle birçok hastada baş ağrısı ve halsizlik de gelişebilir. Anemi ve yetersiz oksijenasyona bağlı olarak nefes darlığı, çarpıntı ve kolay yorulma olabilir.
Lökopeni
Kandaki patlama hücreleri yükseldikçe, yetişkin ve olgun işlevli beyaz kan hücrelerinin sayısı azalır. Buna lökopeni denir. Bu, bağışıklığın azalmasına neden olur ve tekrarlanan enfeksiyon riskini artırır.
Hasta tekrarlayan enfeksiyon atakları ile başvurabilir. Bazıları daha uzun süren basit enfeksiyonlar olabilir ve bazen daha şiddetli bağışıklık depresyonu ile hayatı tehdit eden enfeksiyonlar olabilir.
Kanama riski
Kandaki trombosit sayısının düşmesi nedeniyle kanama riski artar. Buna trombositopeni denir. Burun kanaması, ağır adet kanaması veya diş etlerinden kanama olabilir.
Trombositler normalde pıhtılaşmaya yardımcı olur ve kanamayı önler. Düşük trombosit sayısı, kandaki artan sayıda blast hücresinden kaynaklanır. Küçük yaralanmalardan kaynaklanan morluklar ve yaralanmalardan kaynaklanan ciddi ve kontrolsüz kanamalar olabilir.
Eklemlerde, beyinde vb. kanamalar meydana gelebilir ve hayatı tehdit eden komplikasyonlara neden olabilir. Kanama nedeniyle kemik ve eklem ağrıları olabilir.
Trombositopeni ve anormal kanama ile artan kan pıhtılaşması veya emboli veya tromboz gibi başka bir sorun da olabilir. Sonuç olarak derin ven trombozu (DVT) veya pulmoner emboli (PE) adı verilen hayatı tehdit eden bir komplikasyon olabilir.
Şişme
Şişmiş lenf düğümleri, görülebilecek başka bir yaygın semptomdur. Karaciğer ve dalak büyüyebilir ve karın palpe edildiğinde hissedilebilir.
Nörolojik semptomlar
Kanser merkezi sinir sistemini etkiliyorsa, baş ağrıları, nöbetler veya nöbetler, görme bulanıklığı, boyun sertliği, sinirlilik ve baş dönmesi gibi nörolojik semptomlar olabilir. Bazı hastalarda bulantı ve kusma da görülebilir.
Lökostasis
Patlama hücreleri veya olgunlaşmamış beyaz kan hücreleri, normal beyaz kan hücrelerinden daha büyüktür ve bu nedenle küçük kan damarlarından geçmekte daha fazla zorluk çekerler. Çok yüksek blast hücre sayımı olan ileri vakalarda bu hücreler kan damarlarını tıkar ve kırmızı kan hücrelerinin periferik organlara ve uzuvlara ulaşmasına izin vermez. Buna lökostaz denir.
Bu, baş ağrısı, vücudun bir tarafında güçsüzlük, kafa karışıklığı, baş dönmesi, uyku hali ve geveleyerek konuşma gibi felç benzeri semptomlara yol açabilir. Akciğerdeki kan damarları etkilendiğinde hırıltı ve nefes darlığı olabilir.
Göz kan damarları etkilenirse bulanık görme veya hatta görme kaybı meydana gelebilir. Lökostasis nadirdir ancak acilen tedavi edilmesi gereken tıbbi bir acil durumdur.
Topaklar veya lekeler veya döküntüler
Özellikle AML’deki lösemi hücreleri cilde yayılabilir. Topaklar, lekeler veya döküntüler olarak görünürler. Deri altında tümör benzeri bir AML hücresi topluluğu, kloroma veya granülositik sarkom olarak adlandırılır. AML hücreleri ayrıca diş etlerine yayılarak şişme, ağrı ve kanamaya neden olabilir.
Tanısı
Bir hasta akut miyeloid lösemi semptomları ile başvurursa, bir dizi test istenir. AML’yi teşhis etmek için kullanılan testler aşağıdakileri içerir.
Kan testleri
İlk önce tam bir kan sayımı reçete edilir. Anemi, genellikle 5g/dl’nin altındaki hemoglobin seviyeleri ile saptanır. Ayrıca değişen derecelerde trombositopeni vardır. Bu, düşük trombosit sayısı olduğu anlamına gelir.
Beyaz kan hücresi (WBC) sayısı genellikle yüksektir ancak normal veya düşük olabilir. Nötrofil sayısı genellikle düşüktür.
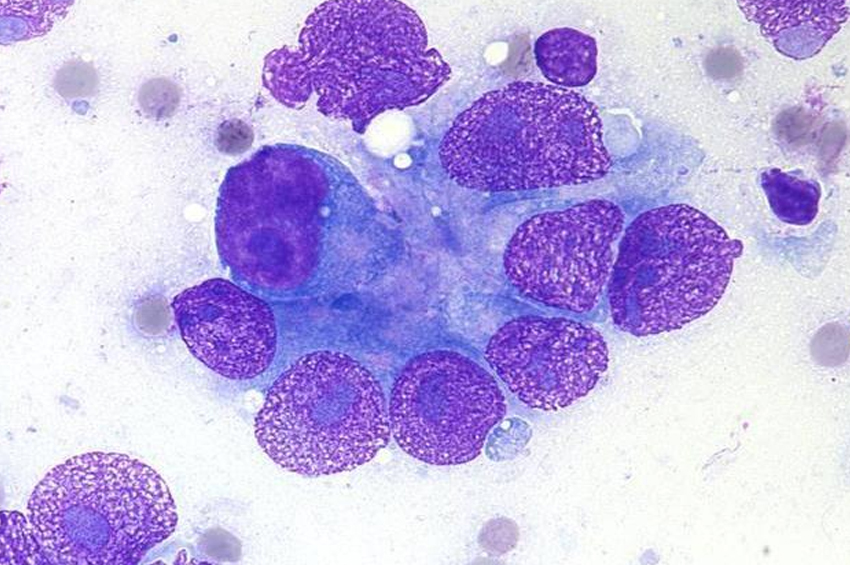
Küçük bir kan örneği bir cam lam üzerine sürüldüğünde ve mikroskop altında incelendiğinde, blast hücrelerinin varlığı olabilir. Buna periferik kan yayması denir. Patlama hücreleri kemik iliği ile sınırlıysa, kan yayması normal olabilir.
Kan pıhtılaşması, yükselmiş protrombin zamanı, düşük fibrinojen seviyesi ve fibrin bozunma ürünlerinin varlığı kontrol edilerek test edilir. Kanda laktik dehidrojenaz seviyeleri yükselebilir. Ayrıca artan hücre ölümü ve oluşumu nedeniyle ürik asit seviyeleri yükselebilir.
Özellikle kemoterapi uygulanmadan önce karaciğer ve böbrek fonksiyonları kontrol edilir. Enfeksiyon durumunda kan kültürleri ve diğer uygun testler reçete edilebilir.
Kemik iliği biyopsisi
Anormal bir kan testi durumunda, kemik iliği biyopsisi reçete edilir. Biyopsi, bir şırınga kullanarak bir kemik iliği numunesi almayı içerir. İğne genellikle kalça kemiğine delinir ve örnek alınır. İşlem ağrılıdır ve lokal anestezi altında yapılır. Prosedürün tamamlanması yaklaşık 15 dakika sürer ve ayakta tedavi bazında gerçekleştirilir.
Kemik iliği örneği kanserli hücreler ve anormal hücreler için kontrol edilir. Hücreler ayrıca lösemi tipini görmek için kontrol edilir.
Lomber ponksiyon veya spinal musluk
Lomber ponksiyon, omurilikten küçük bir beyin omurilik sıvısı numunesi almayı ve anormal kanser hücrelerinin varlığını kontrol etmeyi içerir. Bu, kanserin merkezi sinir sistemine yayıldığı hastalarda pozitif olabilir.
Hastada löseminin merkezi sinir sistemini etkilediğine dair semptomlar olmadıkça, AML’yi test etmek için lomber ponksiyon sıklıkla kullanılmaz. Kemoterapi ilaçlarını BOS’a vermek için bazen bir lomber ponksiyon kullanılır.
Hücre muayenesi
Beyaz kan hücrelerinin boyutunu, şeklini ve diğer özelliklerini kontrol etmek için kan, kemik iliği veya BOS örnekleri mikroskop altında incelenir. Bu, AML türünün sınıflandırılmasına yardımcı olur.
Kemik iliği veya kandaki patlama olan hücrelerin yüzdesi özellikle önemlidir. AML tanısı için genellikle kemik iliğinde veya kanda en az %20 patlama olması gerekir. Patlama yüzdesi %20’ye ulaşmasa bile, belirli AML tiplerinde görülebilen blastlarda kromozom değişikliği olup olmadığı da teşhis edilebilir.
Bazen patlamalar, kemik iliğindeki normal olgunlaşmamış hücrelere benziyor. Ancak normal kemik iliğinde patlama sayısı %5 veya daha azdır. Bir hastanın tedavi sonrası remisyonda sayılabilmesi için kemik iliğindeki blast yüzdesinin %5’ten az olması gerekir.
Sitokimya
Bu testler, lösemi hücrelerinin özel boyalarla boyanmasını içerir. Örneğin, bu lekelerin bazıları, çoğu AML hücresinin granüllerinin mikroskop altında siyah noktalar olarak görünmesine neden olur, ancak TÜM hücrelerin renk değiştirmesine neden olmaz. Bu, kanserler arasında ayrım yapılmasına yardımcı olur.
BT taraması ve görüntüleme çalışmaları
AML hastalarının kalp, akciğer, beyin ve karaciğer gibi ana organlara yayılmayı kontrol etmek için MRI taramaları ve BT taramaları gibi görüntüleme çalışmalarından geçmeleri gerekebilir.
Akış sitometrisi ve immünohistokimya
Bu, kemik iliği ve kan örneklerinden hücrelerin değerlendirilmesine yardımcı olur. Bu testler, tam lösemi tipini belirlemede yardımcı olur.
Bir hücre numunesi, ancak hücre yüzeylerinde spesifik proteinleri mevcutsa hücrelere yapışan özel antikorlarla işlenir. Hücreler daha sonra bir lazer ışınının önünden geçirilir. Lazer ışığı, kendilerine bağlı antikorları olan hücrelerden ışık yayar.
Bilgisayar bu hücrelerin sayısını ve yapısını ölçebilir. İmmünohistokimya testlerinde, kan ve kemik iliği numuneleri spesifik antikorlarla tedavi edilir, böylece bu antikorlara bağlanan proteinlere sahip kanser hücreleri renk değiştirir ve mikroskop altında görülebilir. Bu testler immünofenotipleme için kullanılır.
Sitogenetik
Bu, kanser hücrelerinin genetik planlarını tanımlamayı içerir. Bu testler kullanılarak tanımlanabilen lösemi hücrelerinin atipik genetik yapısı. Genetik anormalliklerin tanımlanması, tedavinin belirlenmesine yardımcı olur.
Yaygın hatalardan veya genetik mutasyonlardan biri translokasyonları içerir. Bu, bir kromozomun bir kısmının diğerinin bir kısmı ile değiştirilebileceği anlamına gelir.
Bu değişiklikleri tanımak, belirli AML tiplerini tanımlamaya ve kanserin olası sonucunu tahmin etmeye yardımcı olabilir. Yaygın translokasyon, t(8;21) içerir, yani kromozom 8’in bir kısmı şimdi kromozom 21’de bulunur ve bunun tersi de geçerlidir.
Başka bir hata türü, bir segmentin hizalamada tersine çevrildiği ters çevirmedir. Örneğin, inv(16), kromozom 16’nın bir kısmının baş aşağı olduğu anlamına gelir. Silme, ekleme ve çoğaltma diğer hata biçimleridir.
Floresan in situ hibridizasyon (FISH)
Bu sitogenetik teste benzer. Bu teknik, yalnızca belirli kromozomların belirli kısımlarına bağlanan floresan boyaları kullanır. Kromozomlara etiketlendikten sonra standart sitogenetik testlerde mikroskop altında görülebilirler. FISH, kromozomlardaki belirli değişiklikleri aramak için kullanılabilir. Kan veya kemik iliği numunelerinde kullanılabilir.
Polimeraz zincir reaksiyonu (PCR)
Bu, bazı kromozom değişikliklerini mikroskop altında görülemeyecek kadar küçük bulabilen başka bir DNA analiz testidir.
Tedavisi
Kemoterapi, AML için standart tedavidir. AML’nin bazı alt türleri diğerlerinden daha kötü bir görünüm taşır. Koşulu olan daha genç insanlar, yaşlı insanlardan daha iyi bir sonuca sahip olma eğilimindedir.
Akut miyeloid löseminin (AML) kemoterapi ile tedavisi iki aşamada sınıflandırılabilir: Remisyon indüksiyonu ve remisyon sonrası tedavi.
AML hastalarının yaklaşık %80’inde, indüksiyon tedavisi tam remisyon sağlar, ancak yüzde yaş artışı ve genetik anormallikler gibi diğer faktörlerle birlikte azalma eğilimi gösterir.
Tam remisyon sağlandığında, remisyon sonrası tedavi başlatılır ve konsolidasyon tedavisi ile idameyi içerir. Remisyon sonrası tedavinin yokluğunda, AML hastalarının %90’ından fazlasında birkaç hafta ila aylar içinde hastalık nüksü meydana gelir.
İndüksiyon kemoterapisi AML hücrelerinin sayısını düşürmeyi amaçlarken, remisyon sonrası tedavinin temel amacı hastalığın tekrarını önlemektir.
Konsolidasyon tedavisi, indüksiyondan iyileşmeden hemen sonra verilen yoğun kemoterapiyi içerir. İndüksiyondan sonra mümkün olan en kısa sürede uygulanır. İndüksiyon ve konsolidasyon birbirine ne kadar yakın verilirse, löseminin tekrarlama şansı o kadar az olur. Daha genç hastalarda konsolidasyon tedavisi için anahtar seçenekler (a) sitarabin kullanan çok sayıda yüksek yoğunluklu kemoterapi döngüsü ve (b) allojenik veya otolog kök hücre naklidir.
İlaçlar açısından, konsolidasyon kemoterapisi ile indüksiyon kemoterapisi arasındaki temel fark, indüksiyon tedavisinde sitarabin ve antrasiklin kullanılırken, konsolidasyonda sadece sitarabin kullanılmasıdır. Bu ilaç, normal olarak 3 veya 4 döngü olmak üzere 4 haftada bir tekrarlanan 5 günlük bir süre boyunca yüksek dozlarda uygulanır.
Kök hücre nakli
Başka bir yaklaşımda, indüksiyon tedavisi sona erdiğinde, yüksek yoğunluklu kemo verilir ve ardından ya allojenik ya da otolog kök hücre nakli yapılır. Genetik anormallikler, hastalığın merkezi sinir sistemine yayılması veya başka rahatsızlıkların varlığı gibi olumsuz prognostik faktörleri olan hastalarda doktorlar genellikle çok yoğun tedaviyi önermektedir. Örneğin, bir kök hücre nakli önerilebilir. Olumlu prognostik faktörlere sahip sağlıklı kişilerde, doktorlar ancak hastalık nüksü olduğunda kök hücre nakli önerebilir.
Otolog kök hücre nakli
Otolog kök hücre naklinde hastanın kendi kök hücreleri kullanılır. Otolog kök hücre nakli, ancak hasta remisyondaysa ve hastanın kendi lösemisiz kök hücrelerini toplama olasılığı varsa bir seçenektir. Hastadan alınan kök hücrelerin, hastalığın tekrarlama olasılığını azaltmak için mevcut olabilecek lösemik hücreleri yok etmek için tedavi edilmesi gerekecektir.
Allojenik kök hücre nakli
Allojenik kök hücre nakli, yoğun radyasyon veya kemoterapiden sonra sağlıklı bir donörden alınan kök hücrelerin hastanın vücuduna transferini içerir. Kök hücre nakli öncesi verilen yüksek yoğunluklu kemoterapi veya radyasyon nedeniyle riskli olabilir. Yoğun radyasyon veya kemoterapi ciddi yan etkilere neden olur ve ayrıca kişinin kendi kök hücrelerini üretme yeteneğini de bozar. Bu yoğun kemoterapinin temel amaçları, mümkün olduğu kadar çok lösemik hücreyi öldürmek ve bağışıklık sistemini devre dışı bırakmak ve böylece bir greft reddi olasılığını azaltmaktır.
Araştırmalar, kök hücre naklinin, hastalığın tekrarlama riskini azaltmada kemoterapiden daha etkili olduğunu göstermiştir. Bununla birlikte, kök hücre nakli oldukça karmaşıktır ve yoğun tedaviyi tolere edemeyecek yaşlı ve kırılgan hastalar da dahil olmak üzere bazı durumlarda ölümcül olabilir. Bazı durumlarda, indüksiyon tedavisi kullanılarak remisyon sağlanamadığında kök hücre nakli önerilebilir.
Konsolidasyon için en iyi tedavi seçeneğini belirlemek kolay değildir ve her yaklaşımın kendi artıları ve eksileri vardır. Doktorların her hasta için en iyi tedaviyi önermeden önce yaş ve sağlık durumu gibi bir dizi faktörü göz önünde bulundurması gerekir. Sağlık durumu kötü olan yaşlı yetişkinler yoğun kemoterapiyi tolere edemeyebilir. Genellikle 1 ila 2 döngü sitarabin veya genellikle daunorubisin veya idarubisin ile birlikte 1 ila 2 döngü standart doz sitarabin içeren düşük yoğunluklu kemoterapi ile tedavi edilebilirler.
Dikkat: Sayfa içeriği sadece bilgilendirme amaçlıdır.